北美临床试验市场规模及份额
Mordor Intelligence北美临床试验市场分析
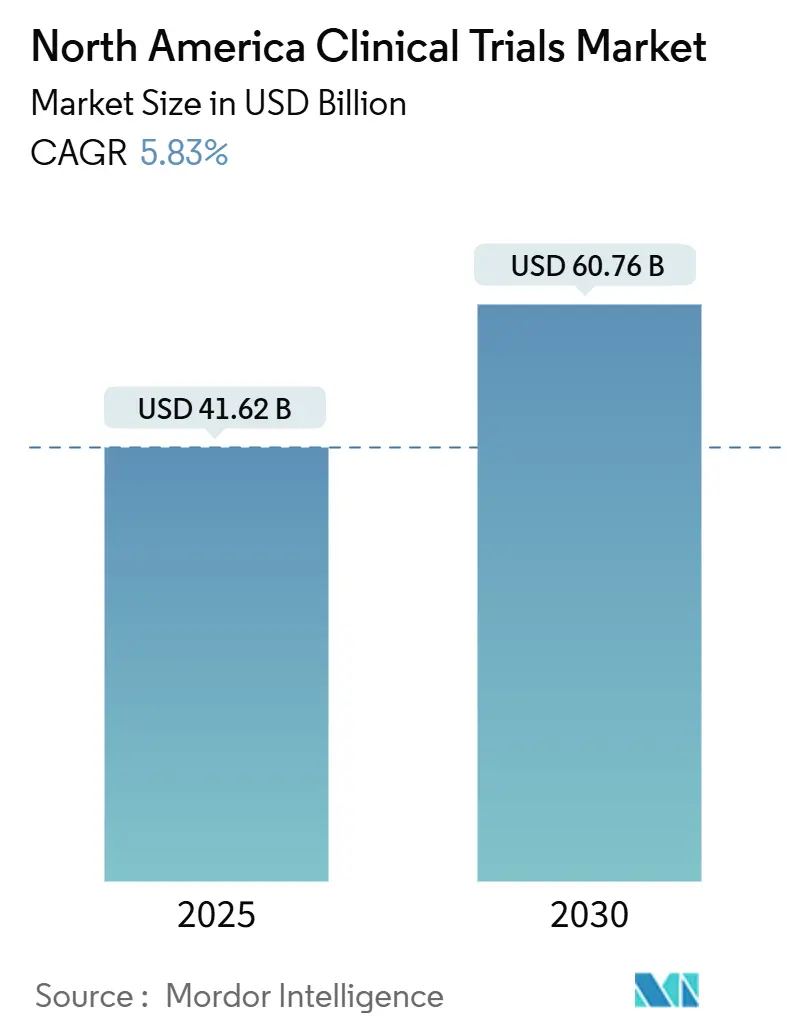
北美临床试验市场规模在2025年达416.2亿美元,预计到2030年将扩展至607.6亿美元,反映出5.83%的复合年增长率。这一持续增长轨迹植根于北美作为全球制药创新中心的地位,由成熟的监管路径、完善的合同研究基础设施和强劲的投资者信心共同支撑,这些因素总计支持超过四分之三的FDA批准[1]美国食品药品监督管理局,《真实世界数据与证据》,fda.gov。AI驱动数据分析的加速采用、慢性疾病负担的加剧,以及卫生管理部门对分散式和适应性设计的认可,显著提升了研究数量,尽管III期试验成本在2024年达到3658万美元。领先CRO的整合(以ICON以120亿美元收购PRA Health Sciences为例)正在产生端到端服务平台,挑战传统的外包模式。
主要报告要点
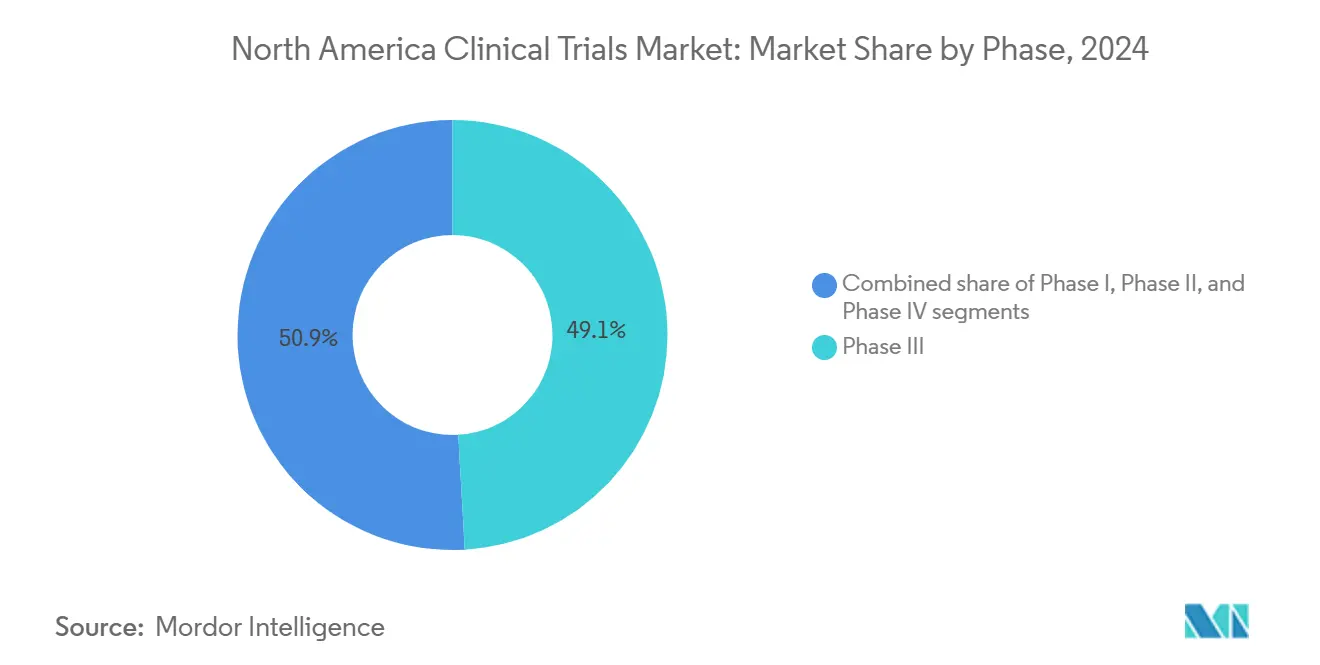
- 按试验阶段划分,III期试验在2024年占据北美临床试验市场份额的49.12%;预计II期将以7.80%的复合年增长率在2030年前领跑增长。
- 按研究设计划分,介入性试验在2024年以72.36%的收入份额占主导地位,而适应性试验有望以8.68%的复合年增长率扩展至2030年。
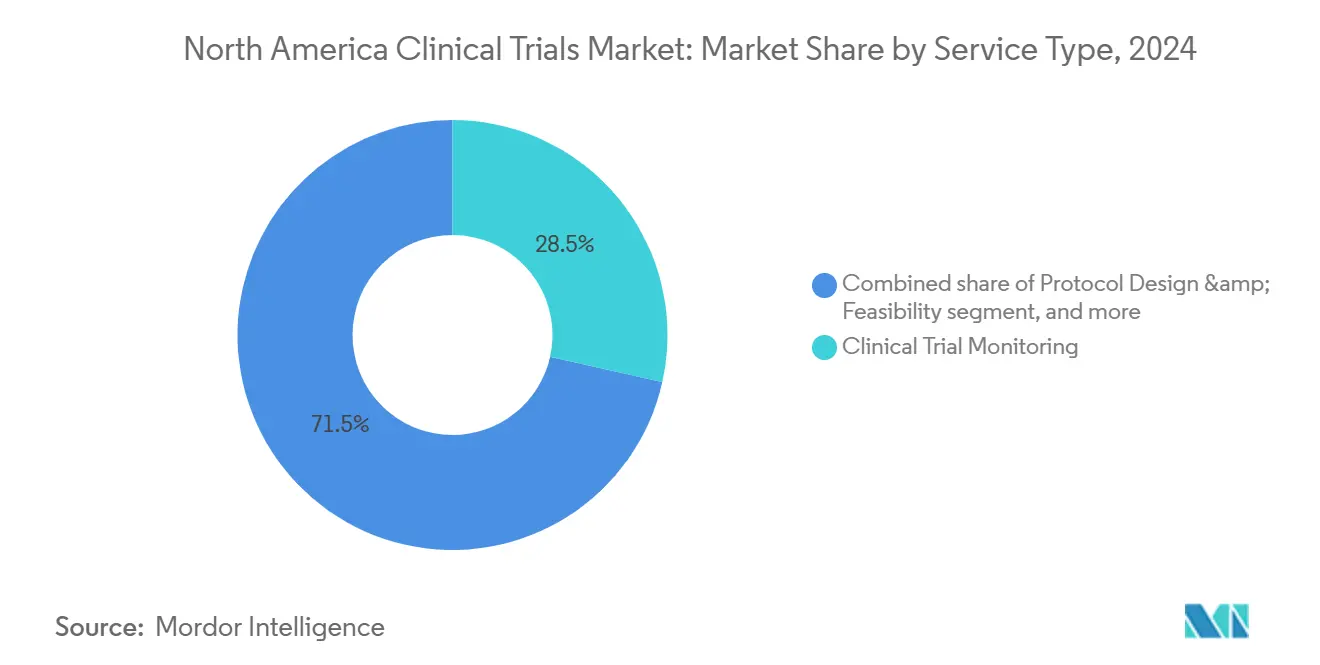
- 按服务类型划分,临床监察在2024年占北美临床试验市场规模的28.55%;分散式服务以8.34%的复合年增长率推进至2030年。
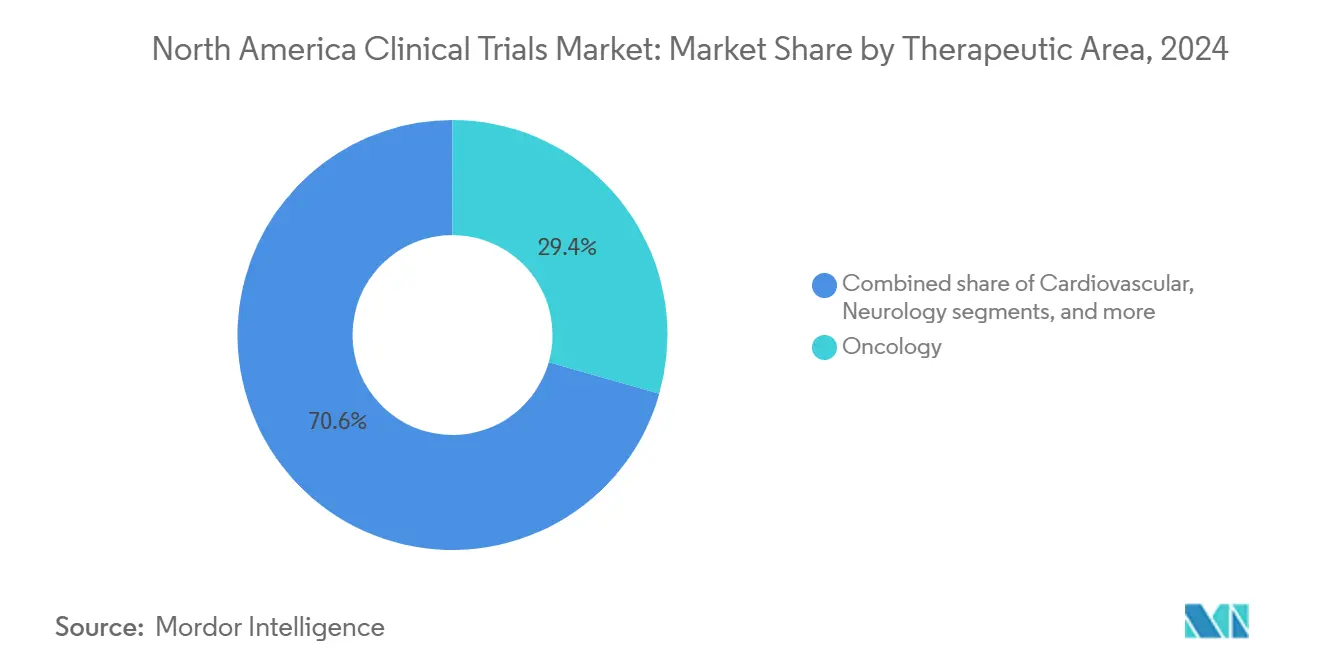
- 按治疗领域划分,肿瘤学在2024年以29.45%的份额领先;预计神经学将以9.43%的复合年增长率在2030年前实现最快增长。
- 按发起人类型划分,制药和生物制药公司在2024年以68.43%的收入份额领先,而政府和非营利组织预计将以7.45%的复合年增长率扩展至2030年。
- 按地理位置划分,美国在2024年控制74.56%的收入,而加拿大有望以6.39%的复合年增长率在2030年前实现最快扩张。
北美临床试验市场趋势与洞察
驱动因素影响分析
| 驱动因素 | 对复合年增长率预测的%影响 | 地理相关性 | 影响时间线 |
|---|---|---|---|
| 强劲的生命科学投资与创新生态系统 | +1.2% | 美国,溢出效应至加拿大 | 长期(≥4年) |
| 高慢性病和罕见病负担产生试验需求 | +1.0% | 北美,老龄化人口 | 中期(2-4年) |
| 支持大规模外包的成熟CRO/研究中心基础设施 | +0.8% | 美国,扩展至加拿大 | 中期(2-4年) |
| FDA和加拿大卫生部对分散式和适应性设计的支持举措 | +0.7% | 美国和加拿大 | 短期(≤2年) |
| 支持混合试验的先进数据共享和数字健康骨干网络 | +0.6% | 北美,美国领先采用 | 中期(2-4年) |
| 吸引发起人资本的有利知识产权保护和报销前景 | +0.5% | 美国,加拿大影响有限 | 长期(≥4年) |
| 来源: Mordor Intelligence | |||
强劲的生命科学投资与创新生态系统
2023年主要制药公司创纪录的1610亿美元研发支出推动了II期和III期项目的涌入,这些项目现在支撑着北美临床试验市场。私募股权动力--以Kohlberg对Worldwide Clinical Trials的投资为亮点--扩大了专门的研究中心网络,缩短了研究启动时间线,加深了治疗专业化。生物技术风险投资在2024年反弹至30亿美元,越来越多地与AI驱动的平台公司挂钩,这些公司要求快速的概念验证读数。Parexel-Palantir等战略联盟将先进分析直接整合到试验运营中,改善方案可行性并加快中期决策。这些汇聚的资本流强化了一个良性循环,即投资带来基础设施升级,进而吸引更多发起人活动在整个北美临床试验市场。
产生试验需求的高慢性病和罕见病负担
老龄化人口和心血管代谢及神经退行性疾病患病率的上升维持了强劲的开发项目管线。北美在阿尔茨海默病研究中占不成比例的份额,区域管线为预计到2033年将达到308亿美元的阿尔茨海默病治疗市场提供支持。糖尿病和肥胖研究的平行增长进一步提升了研究中心利用率,因为GLP-1受体激动剂主导代谢药物领域。此外,肿瘤学精准医学方案现在占全球肿瘤试验的30%,在美国扩展最快,加剧了对生物标志物实验室的需求。监管部门对适应性设计的灵活性使得协议修正能够迅速与不断变化的疾病生物学洞察保持一致,强化了北美临床试验市场的上行潜力。
支持大规模外包的成熟CRO/研究中心基础设施
总部设在北美的CRO管理约75%的全球活跃研究,越来越多地提供结合监察、数据科学和真实世界证据服务的统一产品组合。仅IQVIA每年就支持约1500项试验,利用5.3亿条记录的真实世界数据库优化研究中心选择和入组预测iqvia.com。整合浪潮--如Thermo Fisher 174亿美元收购PPD--正在产生垂直整合平台,将实验室分析与执行能力相结合。先进的基于风险的监察和自动化使CRO能够应对2009年至2020年间记录的67%协议程序增长,同时保持质量和成本纪律。这种结构性优势保护了北美临床试验市场在全球资金紧缩环境中的竞争优势。
FDA和加拿大卫生部对分散式和适应性设计的支持举措
FDA和加拿大卫生部发布的指导正式确定了分散式试验框架,在不妥协GCP标准的情况下实现远程数据采集[2]加拿大卫生部,《临床试验监管现代化》,canada.ca。加拿大卫生部对临床试验申请30天默认审查期为发起人提供了相对于许多OECD同行的快速研究启动,而FDA对远程数据采集工具的明确性催化了混合协议的采用。双边一致性还允许加拿大数据包支持美国监管文件,缩短了数月的跨国提交时间表。这些监管效率直接促进了整个北美临床试验市场的产出,并激励进一步的数字健康投资。
制约因素影响分析
| 制约因素影响分析 | 对复合年增长率预测的(~)%影响 | 地理相关性 | 影响时间线 |
|---|---|---|---|
| 延长审批的复杂多管辖监管环境 | -0.9% | 美国、加拿大、墨西哥 | 中期(2-4年) |
| 熟练研究者、协调员和研究中心人员短缺 | -1.1% | 北美,特别是专科研究中心 | 短期(≤2年) |
| 通胀驱动的研究中心运营和参与者招募成本上升 | -0.8% | 北美,城市学术医疗中心敏感性更高 | 短期(≤2年) |
| 多元化患者队列竞争加剧减慢入组速度 | -0.6% | 美国和加拿大主要大都市研究枢纽 | 中期(2-4年) |
| 来源: Mordor Intelligence | |||
延长审批的复杂多管辖监管环境
不同国家要求经常延迟区域研究启动:墨西哥COFEPRIS平均三个月审批,是加拿大卫生部默认时间线的三倍,迫使错开启动策略,使数据协调复杂化。各管辖区单独的伦理委员会要求进一步延长时间线并增加成本,因为发起人必须在入组开始前获得连续的绿灯。即将到来的2025年ICH E6(R3)修订将收紧元数据标准,需要在研究中心和CRO建立新的数字可追溯系统。综合来看,这些因素通过增加合规复杂性和管理开销来缓解北美临床试验市场原本强劲的增长曲线。
熟练研究者、协调员和研究中心人员短缺
95%的癌症中心报告人员短缺,危及协议依从性并延迟入组基准。2016年至2024年间,研究量增长超过了劳动力扩张,在经验丰富的协调员和数据管理员中造成持续缺口。倦怠和疫情相关的减员加剧了流失,70%的研究中心人员称管理日益增加的协议复杂性变得更加困难。尽管技术平台自动化了源数据验证和参与者参与的各个方面,但即时缓解是不够的;约80%的试验在整个北美临床试验市场错过了初始招募里程碑。由此产生的人员限制挤压了利润率并推高了每位患者的成本,在已识别制约因素中记录了对增长最严重的负面拖累。
细分分析
按试验阶段:晚期阶段主导地位与早期阶段加速并存
III期项目在2024年占据北美临床试验市场49.12%的份额,这一超大足迹反映了监管部门对大型关键研究用于审批决策的依赖。平均III期支出在2024年攀升至3658万美元,因为生物标志物检测、影像终点和患者报告结果为传统疗效指标增加了复杂性,但发起人继续向这些晚期试验投入资源以获得同类首创或同类最佳标签。同时,北美临床试验市场规模中的II期项目预计将以7.80%的复合年增长率扩展至2030年,因为公司优先考虑充分表征的概念验证设计,以减轻下游流失。
越来越多的II期研究利用适应性特征--无效性分析、样本量重新估算和剂量发现算法--基于中期读数实现早期终止或队列扩展,加强商业决策并节约资本。I期试验保持稳定动力,因为免疫肿瘤学和基因治疗模式需要严格的安全性探索,而IV期上市后研究在付费方坚持真实世界证据的情况下重要性上升。这种跨试验阶段的多样化确保了更广泛的北美临床试验行业即使在预算审查下也能保持平衡的增长向量。
备注: 购买报告后可获得所有单个细分市场的市场份额
按研究设计:介入性试验领先而适应性设计变革研究
介入性设计在2024年持有72.36%的份额,强调了监管部门在评估研究性治疗时对随机对照环境的偏好。强大的监督框架和成熟的统计约定巩固了介入性研究作为北美临床试验市场内主要疗效声明黄金标准的地位。然而,适应性试验正在获得速度,预计将实现8.68%的复合年增长率,因为发起人通过前瞻性规划响应中期结果数据的设计修改来获得效率。
FDA关于适应性方法指导的不断增长的资料库缓解了关于I型误差膨胀的历史担忧,促使肿瘤学和罕见疾病产品组合纳入压缩开发时间线的无缝II/III期协议。观察性和扩大准入研究完善了设计组合,提供补充的真实世界数据,为付费方价值档案提供信息。随着监管当局越来越接受主要协议和平台试验,北美临床试验市场规模中的适应性设计将扩大,增强异质性患者人群的灵活性。
按服务类型:监察服务主导而数字解决方案加速
临床监察在2024年产生了28.55%的收入,对保护患者安全和数据完整性仍然不可或缺。基于风险的监察范式现在专注于将现场访问重定向到高风险中心的集中统计触发器,在削减差旅预算的同时保持质量。与此同时,分散式和虚拟试验服务有望实现8.34%的复合年增长率,受到远程医疗采用和收集砖石诊所外连续生物识别终点的可穿戴设备推动。
协议设计咨询、数据管理和医学撰写运营共同拓宽了服务堆栈,使全服务CRO能够锁定多年主服务协议。电子知情同意、电子患者报告结果和直接向患者药物配送解决方案的整合重新定义了整个北美临床试验市场的参与者参与模式。对AI驱动研究中心支持平台的投资--以IQVIA的虚拟研究中心网络工具为例--有望压缩启动间隔并围绕数据质量热点重新调整监察范式。
备注: 购买报告后可获得所有单个细分市场的市场份额
按治疗领域:肿瘤学领导地位受到神经学创新挑战
肿瘤学在2024年保持29.45%的份额,受到针对肿瘤不可知性通路和细胞治疗构建的精准医学资产的持续风险和制药支出支撑。免疫检查点抑制剂、抗体-药物偶联物和CAR-T管线共同占患者量上升,需要复杂的生物标志物实验室服务和基因组同意框架。预计神经学将以9.43%的复合年增长率超越所有其他专科至2030年,因为疾病修饰性阿尔茨海默病候选药物和新型帕金森病基因治疗进入关键阶段,重塑北美临床试验市场内的投资流。
心血管、代谢和感染性疾病领域保持中等个位数增长,后COVID治疗重点现在扩展到长COVID综合征和下一代抗病毒预防。免疫学和肿瘤学产品组合的加速融合产生了篮子和伞状协议,根据分子特征而非器官部位分类学招募患者。这些方法论创新强化了北美临床试验行业作为跨高未满足需求类别的同类首创疗法全球试验场的定位。
备注: 购买报告后可获得所有单个细分市场的市场份额
按发起人类型:制药主导地位与政府研究扩张并存
制药和生物制药公司在2024年占研究启动的68.43%,利用深厚的研发预算和监管专业知识来引导晚期执行管线。大型制药公司与学术医疗中心和生物技术创新者的联盟网络培育早期发现资产,同时将执行复杂性外包给CRO,从而维持北美临床试验市场的广泛范围。
政府和非营利实体预计将以7.45%的复合年增长率增长,调动诸如加拿大2.5亿美元临床试验基金等公共卫生拨款来解决疫苗准备和被忽视疾病。学术研究者在合作拨款结构和共享生物信息学基础设施的支持下,越来越多地发起研究者发起的试验,为行业项目提供确认性数据集。医疗器械发起人增加了多样性,推动更小、更快的IDE研究,迅速转向FDA de novo或510(k)申请。总的来说,这种发起人概况的马赛克分散了资金风险,并锚定了整个北美临床试验行业景观的稳定产出。
地理分析
美国控制了2024年74.56%的收入,预计将与更广泛的北美临床试验市场一起以稳定的5.83%复合年增长率增长至2030年。先进医疗系统、广泛学术网络和渐进式FDA框架的融合维持了其无与伦比的试验研究中心密度。领先的CRO总部--达勒姆的IQVIA、威尔明顿的PPD和费城的ICON--锚定了熟练掌握分散式和适应性方法的劳动力,能够快速部署同时询问多个终点的主要协议。持续的风险和私募股权流入将资本注入专门的研究中心网络,抑制患者招募延迟并巩固该国的创新领导地位。
加拿大有望实现最快扩张,北美临床试验市场规模中归因于加拿大运营的部分预计将以6.39%的复合年增长率增长至2030年。加拿大卫生部的30天审查政策为发起人提供快速入口,而与ICH标准的一致性使加拿大数据包能够为FDA和EMA提交提供支持,而无需冗余申请。战略创新基金等政府激励措施补贴基础设施升级,加拿大临床试验资产地图向外国发起人推广研究中心能力。此外,成本效率--通常比美国每位患者支出低20%--增强了加拿大的吸引力,特别是对于受益于该国种族多样化患者群体的早期肿瘤学和罕见疾病队列。
墨西哥虽然目前贡献较小,但随着COFEPRIS简化其监管架构并采用ICH GCP,呈现出令人信服的势头。2024年等效协议允许在没有完整营销授权的情况下进口研究性产品,减少了跨国试验的物流摩擦。墨西哥与美国的接近性支持跨境研究中心配对策略,丰富了FDA指导中的多样性要求,而有利的成本结构吸引发起人探索IV期药物警戒和真实世界证据项目。然而,协调复杂性和伦理委员会排序要求缓解了近期采用。随着这些程序瓶颈的缓解,墨西哥将加强北美临床试验市场的地理深度并扩大区域患者准入渠道。
竞争格局
北美拥有适度集中但竞争激烈的CRO领域,最近的大型交易放大了规模和服务广度。ICON对PRA Health Sciences的吸收和Thermo Fisher对PPD的整合打造了两个能够从试验设计跨越到生物分析测试的端到端平台,产生了吸引寻求单一供应商责任制发起人的协同效应[3]IQVIA Holdings Inc.,《2024年年报》,iqvia.com。IQVIA领跑,将19%的全球CRO份额与专有真实世界数据集相结合,后者为预测入组算法和治疗领域基准提供支持。协同能力产生谈判杠杆并锁定延伸到单个试验之外的合同,缓冲北美临床试验市场内的收入波动性。
技术融合是一个决定性的战场。Parexel与Palantir的联盟将AI驱动分析嵌入EDC系统,而Tempus对Deep 6 AI的收购通过实时EMR挖掘加强了精准招募。Lindus Health等新兴企业凭借1800万美元A轮融资,倡导软件优先模式,承诺快速可行性评估和更低固定开销。成熟参与者通过内部孵化器和风险基金收购或许可小众数字资产来反击,在分散式实施获得主流地位时保持竞争定位。
私募股权仍然是变革力量,将资本注入研究中心网络和专业供应商。Kohlberg在Worldwide Clinical Trials的股份和VSS Capital对Eximia Research的注资说明了对增长平台的兴趣,这些平台可以被整合到更大的实体中或通过IPO上市。随着劳动力短缺持续,收购方青睐拥有嵌入式培训学院和标准化SOP的网络,以减轻劳动力风险。因此,竞争强度将加剧,但规模、数据深度和数字灵巧性将仍然是北美临床试验市场市场领导地位的决定性差异化因素。
北美临床试验行业领导者
ICON公司
IQVIA
Parexel International
Syneos Health
美国实验室公司(Covance)
- *免责声明:主要玩家排序不分先后
近期行业发展
- 2025年3月:ICON公司和PRA Health Sciences完成了120亿美元的合并,创建了整合移动健康技术的领先混合试验CRO平台。
- 2025年1月:Suvoda和Greenphire同意合并,结合随机化、试验供应管理和患者付费专业知识以简化参与者旅程。
- 2025年1月:Faro Health和Recursion建立合作伙伴关系,将AI嵌入临床试验设计工作流程,提高协议效率。
- 2024年12月:Thermo Fisher Scientific完成了对PPD的174亿美元收购,提升了其综合药物开发服务足迹。
- 2024年10月:Exelixis和MSD建立临床合作,旨在通过联合试验执行推进肿瘤学治疗。
北美临床试验市场报告范围
根据报告范围,临床试验是在临床研究下进行并遵循规范协议的实验。这些实验主要用于获得关于新开发药物安全性和有效性的数据。临床试验数据对于药物批准以及其在市场上的引入是强制性的。这些试验在三个阶段(I、II、III和IV)下进行,这取决于各种因素。这个过程不仅昂贵,而且耗时,在所有阶段都需要专业知识。北美临床试验市场按试验阶段(I期、II期、III期和IV期)、按设计(治疗研究和观察研究)和地理位置(美国、加拿大和墨西哥)进行细分。报告为上述细分市场提供美元(美元)百万价值。
| I期 |
| II期 |
| III期 |
| IV期 |
| 介入/治疗研究 |
| 观察研究 |
| 扩大准入研究 |
| 协议设计与可行性 |
| 研究中心识别与启动 |
| 监管提交与批准 |
| 临床试验监察 |
| 数据管理与生物统计 |
| 医学撰写 |
| 其他服务类型 |
| 肿瘤学 |
| 心血管 |
| 神经学 |
| 感染性疾病 |
| 代谢疾病(糖尿病、肥胖) |
| 免疫学/自身免疫 |
| 其他治疗领域 |
| 制药和生物制药公司 |
| 医疗器械公司 |
| 学术和研究机构 |
| 政府和非营利组织 |
| 美国 |
| 加拿大 |
| 墨西哥 |
| 按试验阶段 | I期 |
| II期 | |
| III期 | |
| IV期 | |
| 按研究设计 | 介入/治疗研究 |
| 观察研究 | |
| 扩大准入研究 | |
| 按服务类型 | 协议设计与可行性 |
| 研究中心识别与启动 | |
| 监管提交与批准 | |
| 临床试验监察 | |
| 数据管理与生物统计 | |
| 医学撰写 | |
| 其他服务类型 | |
| 按治疗领域 | 肿瘤学 |
| 心血管 | |
| 神经学 | |
| 感染性疾病 | |
| 代谢疾病(糖尿病、肥胖) | |
| 免疫学/自身免疫 | |
| 其他治疗领域 | |
| 按发起人类型 | 制药和生物制药公司 |
| 医疗器械公司 | |
| 学术和研究机构 | |
| 政府和非营利组织 | |
| 地理位置 | 美国 |
| 加拿大 | |
| 墨西哥 |
报告中回答的关键问题
北美临床试验市场的当前价值是多少?
该市场在2025年价值416.2亿美元,预计到2030年将达到607.6亿美元。
哪个阶段在北美临床试验中产生最大收入?
III期试验贡献最多,持有2024年49.12%的收入,反映发起人对关键研究的关注。
为什么适应性试验设计越来越被采用?
FDA和加拿大卫生部的监管指导澄清了统计期望,使发起人能够在研究过程中修改协议并压缩时间线。
加拿大临床试验细分市场增长多快?
加拿大预计将以6.39%的复合年增长率扩展至2030年,受其30天CTA审查期和成本效率的帮助。
试验研究中心面临的主要运营挑战是什么?
经验丰富的研究者和协调员的严重短缺导致80%的研究错过初始入组目标,增加每位患者成本。
技术如何重塑竞争格局?
CRO正在将AI、基于风险的监察和分散式平台嵌入服务模式,以减少周期时间并从发起人那里赢得"一站式"合同。
页面最后更新于: