Taille du Marché de Emballage sous contrat pharmaceutique Industrie
| Période d'étude | 2019 - 2029 |
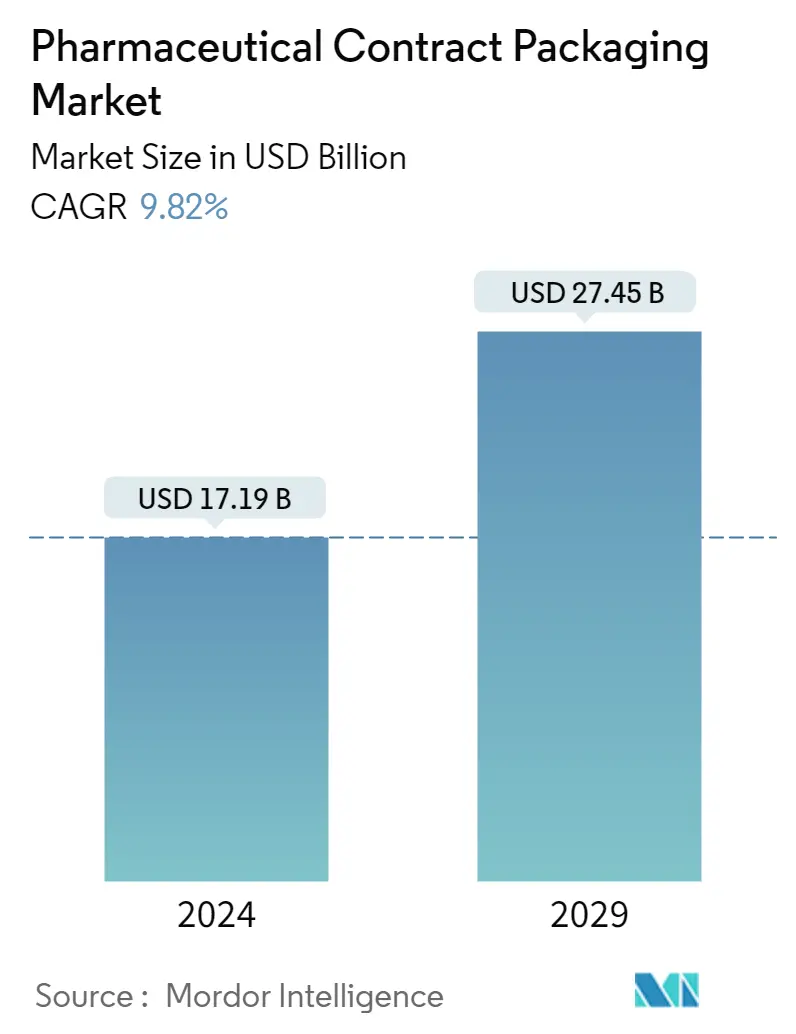
| Taille du Marché (2024) | USD 17,19 milliards de dollars |
| Taille du Marché (2029) | USD 27,45 milliards de dollars |
| TCAC(2024 - 2029) | Equal-9.82 |
| Marché à la Croissance la Plus Rapide | Asie-Pacifique |
| Plus Grand Marché | Amérique du Nord |
| Concentration du marché | Faible |
Principaux acteurs
*Avis de non-responsabilité : les principaux acteurs sont triés sans ordre particulier |
Besoin d'un rapport qui reflète l'impact de la COVID-19 sur ce marché et sa croissance ?
Analyse du marché de lemballage sous contrat pharmaceutique
La taille du marché de lemballage sous contrat pharmaceutique est estimée à 17,19 milliards USD en 2024 et devrait atteindre 27,45 milliards USD dici 2029, avec une croissance de 9,82 % au cours de la période de prévision (2024-2029)
Alors que le COVID-19 a entraîné une augmentation significative de la demande de flacons, de médicaments et dautres médicaments, les fabricants du secteur ont mobilisé leurs ressources et ont fait pression pour accélérer les processus de fabrication et de conditionnement. Au cours des premiers mois de la pandémie, le marché a connu une pénurie importante de matériel pour les CMO et les CPO ; en raison des problèmes de chaîne d'approvisionnement rencontrés dans la région Asie-Pacifique, qui occupe une position de premier plan en ce qui concerne les matières premières pharmaceutiques ainsi que les matières premières de l'industrie de l'emballage, ce qui a entraîné un ralentissement de la fabrication et de l'emballage
- Lindustrie pharmaceutique mondiale connaît une croissance exponentielle, portée par la croissance économique mondiale, une population croissante et vieillissante et le lancement de nouveaux produits. Selon IQVIA, les revenus du marché pharmaceutique mondial en 2020 se sont élevés à 1 265,2 milliards de dollars et ont augmenté à un rythme soutenu. Alors que de nombreux fournisseurs de produits pharmaceutiques ont reconnu que leurs bénéfices pourraient être augmentés en sous-traitant l'emballage commercial et clinique à un sous-traitant pharmaceutique, l'emballage sous contrat dans l'industrie se développe.
- Au cours des dernières années, le nombre de nouveaux médicaments approuvés par la FDA américaine a considérablement augmenté. Par exemple, le nombre total de nouveaux médicaments approuvés par le CDER en 2020 s'élevait à 53, contre 48 l'année précédente, selon la Food and Drug Administration (Centre d'évaluation et de recherche sur les médicaments (CDER)). De plus, le programme de médicaments génériques a approuvé ou provisoirement approuvé 948 demandes de médicaments génériques au cours de l'année. Laugmentation du nombre de nouveaux médicaments approuvés par la FDA a eu un impact positif sur le marché mondial de lemballage sous contrat pharmaceutique.
- En outre, les produits injectables devraient connaître une part de marché accrue, dépassant les autres voies d'administration telles que la voie orale au cours des années à venir ; de ce fait, la demande de solutions injectables est susceptible d'augmenter dans le conditionnement sous contrat, et les principaux fournisseurs de produits pharmaceutiques devraient étendre leurs capacités dans cet espace.
- Par exemple, en janvier 2021, Novartis a réalisé un investissement stratégique dans la société de distribution de médicaments Credence MedSystems ; l'investissement devrait contribuer à faire progresser le développement et la mise à l'échelle des systèmes d'administration de médicaments de Credence, en mettant l'accent dans un premier temps sur le système de seringues de sécurité Credence Companion.
- De plus, la demande dexternalisation des services dembouteillage devrait être stable sur le marché des volumes plus importants. Le besoin de services d'emballage sous blister et d'embouteillage devrait être motivé par les médicaments d'entretien et la demande d'options d'emballage efficaces pour la mise sur le marché des nouveaux produits, en se concentrant sur des présentations de 30 à 60 à 90 jours pour les médicaments d'entretien.
- En outre, la réglementation de l'UE oblige tous les fabricants de produits pharmaceutiques à se conformer aux bonnes pratiques de fabrication (BPF) de l'UE s'ils souhaitent fournir des produits à l'UE. Les fabricants et importateurs doivent ensuite être agréés et enregistrés par une autorité compétente d'un État membre. Les fabricants et importateurs sont régulièrement inspectés par une autorité compétente de lUE ou une autre autorité agréée pour vérifier la conformité aux BPF de lUE. Ce processus s'applique partout où le fabricant est situé. Lorsqu'une entreprise particulière importe des produits, l'importateur est responsable de garantir le respect des BPF. La législation de l'UE régissant les produits pharmaceutiques est compilée dans Les règles régissant les produits médicaux dans l'Union européenne.