Tamaño del Mercado de Pruebas y certificación globales de dispositivos médicos Industria
| Período de Estudio | 2019 - 2029 |
| Tamaño del Mercado (2024) | USD 10.55 Billion |
| Tamaño del Mercado (2029) | USD 12.71 Billion |
| CAGR (2024 - 2029) | 3.80 % |
| Mercado de Crecimiento Más Rápido | Asia Pacífico |
| Mercado Más Grande | América del norte |
| Concentración del Mercado | Bajo |
Jugadores Principales
*Nota aclaratoria: los principales jugadores no se ordenaron de un modo en especial |
¿Necesita un informe que refleje la manera en la que el COVID-19 ha impactado en este mercado y su crecimiento?
Análisis del mercado de pruebas de dispositivos médicos
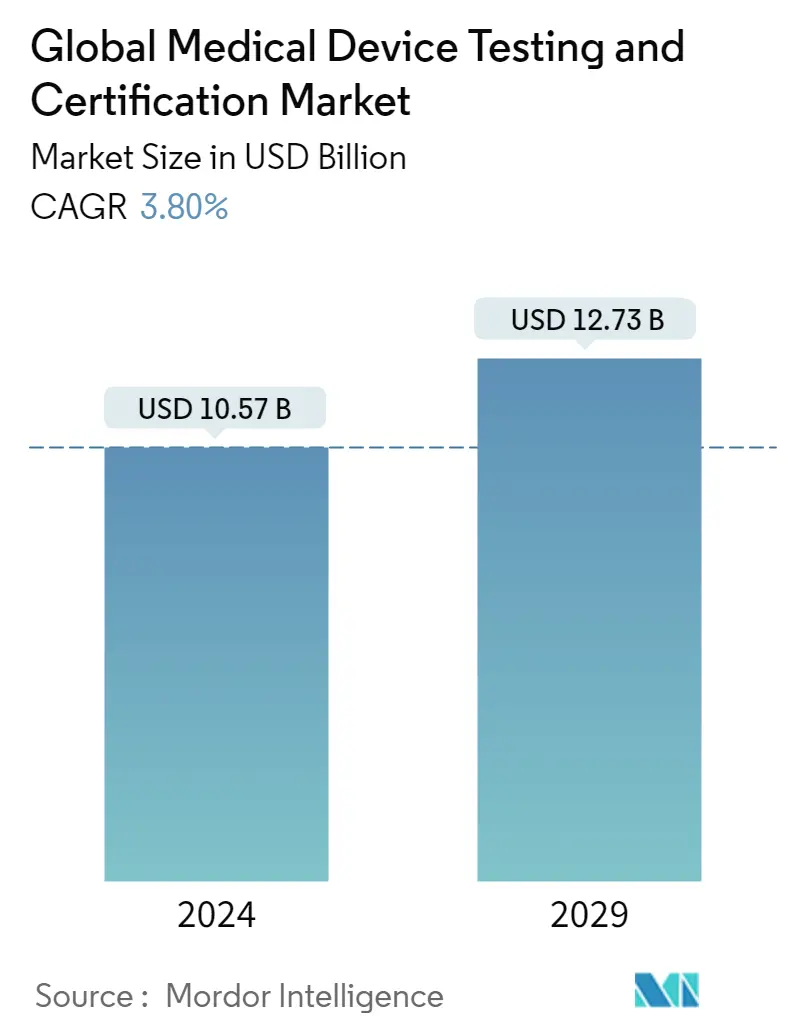
El tamaño del mercado mundial de pruebas y certificación de dispositivos médicos se estima en 10,57 mil millones de dólares en 2024, y se espera que alcance los 12,73 mil millones de dólares en 2029, creciendo a una tasa compuesta anual del 3,80% durante el período previsto (2024-2029)
Durante el brote de COVID-19 en 2020, se tomaron varias medidas para prevenir la transmisión de enfermedades, como medidas de bloqueo y restricción de las actividades de importación y exportación entre los países, lo que interrumpió la cadena de suministro y afectó negativamente al mercado general estudiado
Además, la interrupción causada por la COVID-19 en las cadenas de suministro internacionales ha provocado escasez de dispositivos médicos críticos en todo el mundo. Por lo tanto, muchos países han tomado medidas definitivas para aliviar la escasez importando equipos, como la fabricación nacional de dispositivos médicos. Además, se espera que la fabricación nacional de dispositivos médicos esenciales supere las barreras comerciales y, al mismo tiempo, garantice la calidad del producto y la estabilidad del mercado
Según British Standards Institution (BSI), en febrero de 2020, teniendo en cuenta los efectos de la pandemia de COVID-19, la empresa revisó los procesos y planificó un programa para minimizar el riesgo para los clientes y colegas de British Standards Institution (BSI) manteniendo al mismo tiempo requisitos de acreditación y mitigar los posibles riesgos comerciales globales
Los dispositivos médicos están sujetos a cumplir estrictos protocolos regulatorios, ya que es vital para garantizar la eficacia y seguridad de los dispositivos médicos. Por lo tanto, es obligatorio que cada dispositivo cumpla con los estándares nacionales e internacionales antes de ingresar al mercado. Las pautas estándar de dispositivos médicos varían de un país a otro y es obligatorio que todos los fabricantes sigan estas pautas para comercializar o vender sus productos en un país. Por ejemplo, Estados Unidos sigue las directrices de la Administración de Alimentos y Medicamentos (FDA), Europa considera la aprobación de la Conformidad Europea (CE), Canadá necesita el Registro de Salud de Canadá y la India requiere la aprobación de la Organización Central de Control de Estándares de Medicamentos (CDSCO). Esta amplia gama de panoramas regulatorios impulsa el mercado de pruebas y certificación
Dado que las regulaciones son diferentes en cada país, es crucial que cada fabricante de dispositivos médicos registre o reciba pautas regulatorias de ese país específico, lo que, a su vez, indica la necesidad de que terceros autorizados registren sus dispositivos. Las autoridades reguladoras nacionales de cada país prefieren que los fabricantes que venden sus productos en ese país en particular cumplan con las pautas estándar y las verifiquen mediante un sistema de certificación de terceros
Esto puede dar como resultado impulsar el mercado de pruebas y certificación, así como aumentar el fácil acceso al mercado. Los otros factores, como la creciente necesidad de validación y verificación (VV) de dispositivos médicos, están impulsando el mercado de pruebas y certificación de dispositivos médicos. Sin embargo, se espera que un factor como la diversidad en la regulación impida el crecimiento del mercado durante el período previsto