| Período de Estudio | 2019 - 2029 |
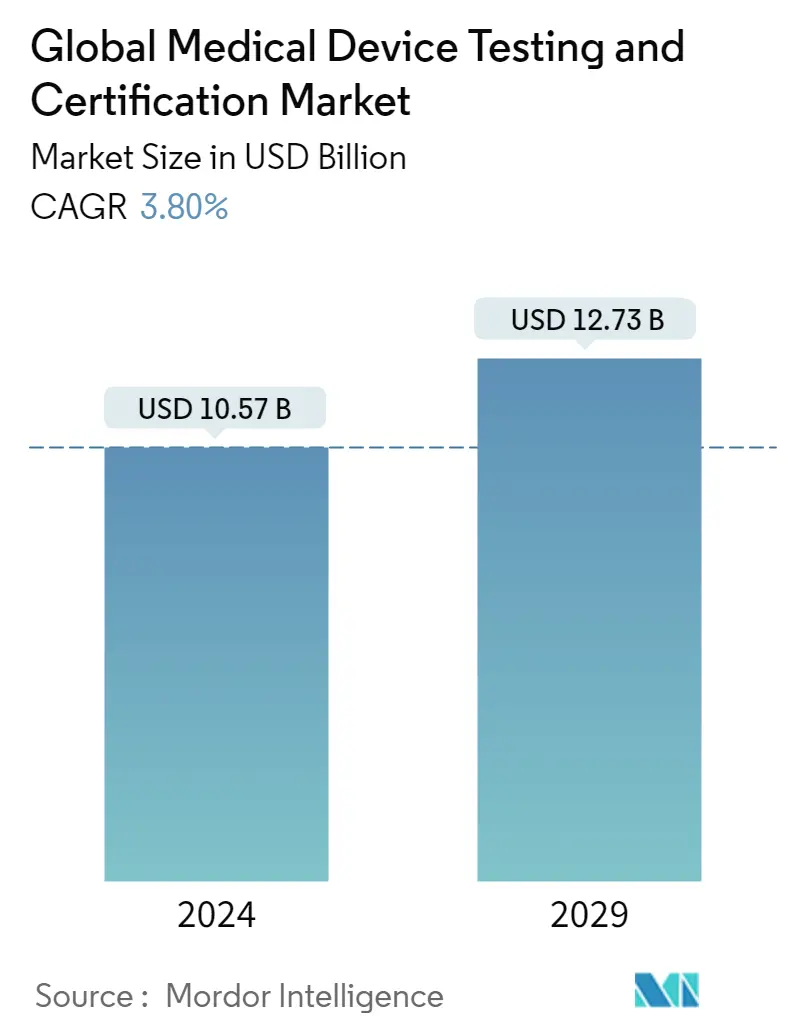
| Tamaño del Mercado (2024) | USD 10.55 Billion |
| Tamaño del Mercado (2029) | USD 12.71 Billion |
| CAGR (2024 - 2029) | 3.80 % |
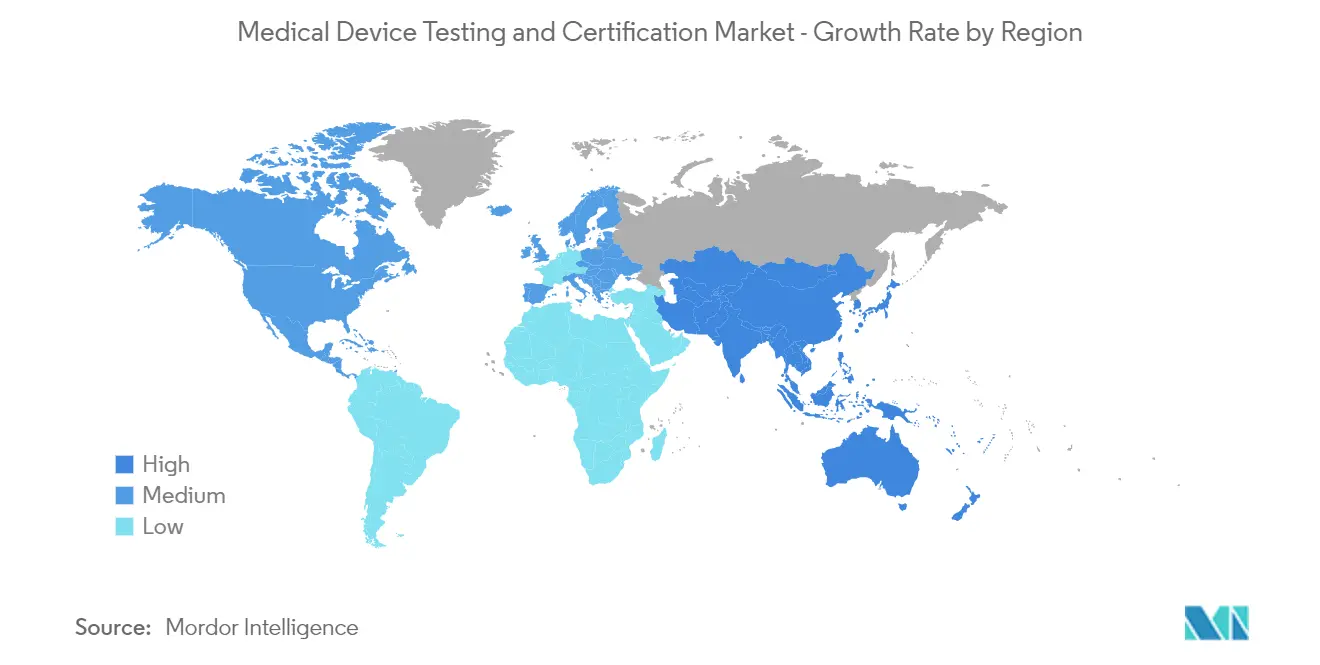
| Mercado de Crecimiento Más Rápido | Asia Pacífico |
| Mercado Más Grande | América del norte |
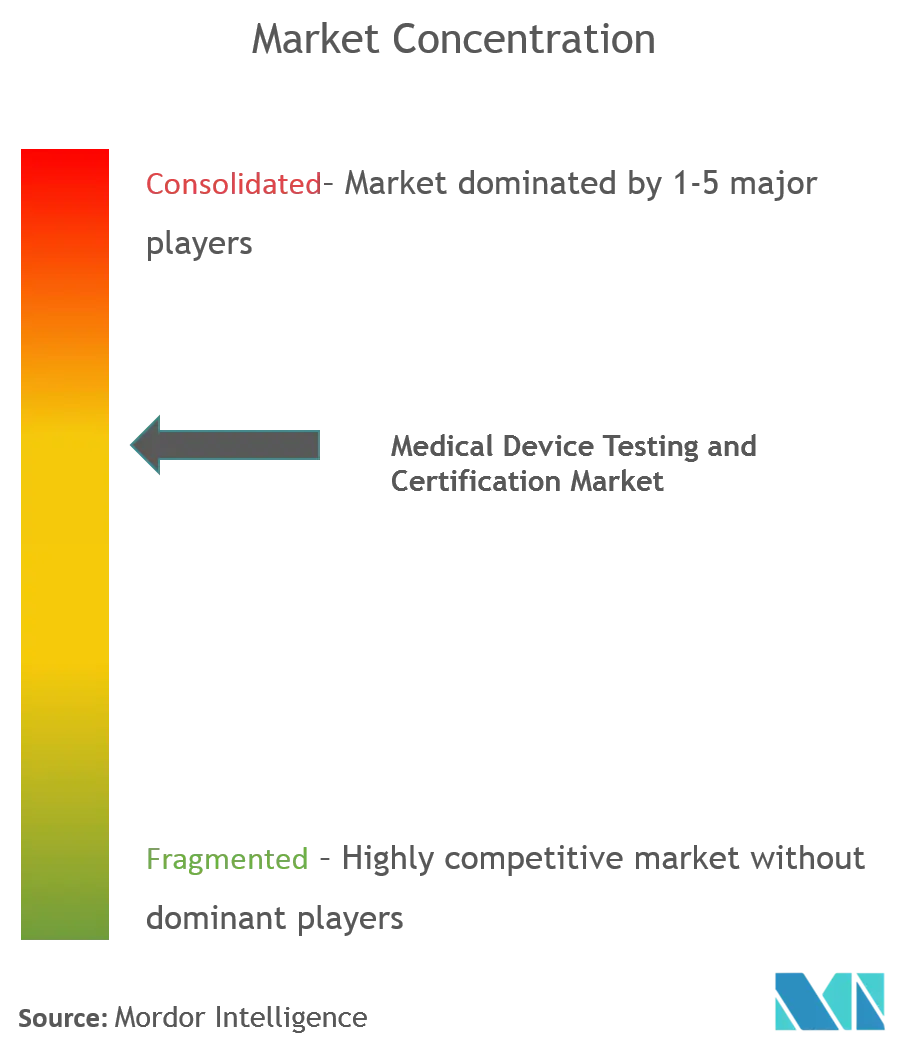
| Concentración del Mercado | Bajo |
Jugadores principales*Nota aclaratoria: los principales jugadores no se ordenaron de un modo en especial |
Análisis del mercado de pruebas de dispositivos médicos
El tamaño del mercado mundial de pruebas y certificación de dispositivos médicos se estima en 10,57 mil millones de dólares en 2024, y se espera que alcance los 12,73 mil millones de dólares en 2029, creciendo a una tasa compuesta anual del 3,80% durante el período previsto (2024-2029).
Durante el brote de COVID-19 en 2020, se tomaron varias medidas para prevenir la transmisión de enfermedades, como medidas de bloqueo y restricción de las actividades de importación y exportación entre los países, lo que interrumpió la cadena de suministro y afectó negativamente al mercado general estudiado.
Además, la interrupción causada por la COVID-19 en las cadenas de suministro internacionales ha provocado escasez de dispositivos médicos críticos en todo el mundo. Por lo tanto, muchos países han tomado medidas definitivas para aliviar la escasez importando equipos, como la fabricación nacional de dispositivos médicos. Además, se espera que la fabricación nacional de dispositivos médicos esenciales supere las barreras comerciales y, al mismo tiempo, garantice la calidad del producto y la estabilidad del mercado.
Según British Standards Institution (BSI), en febrero de 2020, teniendo en cuenta los efectos de la pandemia de COVID-19, la empresa revisó los procesos y planificó un programa para minimizar el riesgo para los clientes y colegas de British Standards Institution (BSI) manteniendo al mismo tiempo requisitos de acreditación y mitigar los posibles riesgos comerciales globales.
Los dispositivos médicos están sujetos a cumplir estrictos protocolos regulatorios, ya que es vital para garantizar la eficacia y seguridad de los dispositivos médicos. Por lo tanto, es obligatorio que cada dispositivo cumpla con los estándares nacionales e internacionales antes de ingresar al mercado. Las pautas estándar de dispositivos médicos varían de un país a otro y es obligatorio que todos los fabricantes sigan estas pautas para comercializar o vender sus productos en un país. Por ejemplo, Estados Unidos sigue las directrices de la Administración de Alimentos y Medicamentos (FDA), Europa considera la aprobación de la Conformidad Europea (CE), Canadá necesita el Registro de Salud de Canadá y la India requiere la aprobación de la Organización Central de Control de Estándares de Medicamentos (CDSCO). Esta amplia gama de panoramas regulatorios impulsa el mercado de pruebas y certificación.
Dado que las regulaciones son diferentes en cada país, es crucial que cada fabricante de dispositivos médicos registre o reciba pautas regulatorias de ese país específico, lo que, a su vez, indica la necesidad de que terceros autorizados registren sus dispositivos. Las autoridades reguladoras nacionales de cada país prefieren que los fabricantes que venden sus productos en ese país en particular cumplan con las pautas estándar y las verifiquen mediante un sistema de certificación de terceros.
Esto puede dar como resultado impulsar el mercado de pruebas y certificación, así como aumentar el fácil acceso al mercado. Los otros factores, como la creciente necesidad de validación y verificación (VV) de dispositivos médicos, están impulsando el mercado de pruebas y certificación de dispositivos médicos. Sin embargo, se espera que un factor como la diversidad en la regulación impida el crecimiento del mercado durante el período previsto.
Tendencias del mercado de pruebas de dispositivos médicos
Se espera que el segmento de servicios de pruebas experimente un rápido crecimiento durante el período de pronóstico
A nivel mundial, los dispositivos médicos están regulados por diversas autoridades regulatorias y cumplimientos. Esto se debe principalmente a que los usuarios finales de estos dispositivos esperan un rendimiento, eficacia y seguridad excepcionales de estos dispositivos médicos. Por lo tanto, es obligatorio que los fabricantes definan e implementen adecuadamente una estrategia de prueba de dispositivos médicos, lo que hace que el dispositivo sea efectivo y la producción sea más fácil debido a la confirmación de la calidad.
En abril de 2020, debido a la pandemia de COVID-19, la Comisión Europea (CE) adoptó una propuesta para posponer la fecha de aplicación del Reglamento de Dispositivos Médicos (MDR) por un año porque la pandemia de COVID-19 aumentó la demanda de ciertos dispositivos médicos. que eran cruciales para evitar riesgos o dificultades de posible escasez de dichos dispositivos. Además, la pandemia de COVID-19 ha retrasado los ensayos clínicos y ha interrumpido los procesos de los dispositivos médicos.
Algunos de los dispositivos médicos experimentaron un aumento repentino en la demanda durante la pandemia de COVID-19 de 2020. Por ejemplo, los ventiladores tuvieron una gran demanda para los pacientes de COVID-19, ya que son una herramienta importante en los hospitales que puede mantener con vida a los pacientes en condiciones críticas.. Por ejemplo, en marzo de 2020, Medtronic PLC anunció que había aumentado la producción en más de un 40 % hasta la fecha y estaba en camino de duplicar con creces su capacidad para fabricar y suministrar ventiladores en respuesta a las necesidades urgentes de los pacientes y los sistemas sanitarios en todo el mundo. mundo frente al COVID-19.
En junio de 2020, Intertek Group PLC anunció la expansión de los servicios de equipos de protección personal para incluir pruebas de respiradores N95 según los requisitos establecidos por el Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH). Con esta expansión, la empresa también amplió sus soluciones y recursos para apoyar a los clientes y a la comunidad global durante la pandemia de COVID-19.
Una estrategia eficaz de prueba de dispositivos médicos necesita varios conjuntos de requisitos de prueba. Los conjuntos de requisitos son necesarios para facilitar la implementación de las pruebas, ya que las pruebas se llevan a cabo continuamente en diferentes etapas del proceso de fabricación completo, desde la selección de componentes hasta el ensamblaje final de un dispositivo médico. Cada etapa tiene diferentes requisitos y diferentes parámetros a satisfacer. Por lo tanto, el aumento de los dispositivos médicos también puede aumentar estos servicios de prueba, lo que se espera que aumente el crecimiento general del mercado.
América del Norte domina el mercado y se espera que haga lo mismo durante el período de pronóstico
Algunos de los factores que impulsan el crecimiento del mercado en la región de América del Norte incluyen un mayor enfoque en la calidad de los dispositivos médicos y la presencia de una gran cantidad de empresas que prestan servicios en la industria de dispositivos médicos, junto con la presencia de atención médica bien desarrollada y la presencia de las principales empresas multinacionales de dispositivos médicos.
Según un artículo de investigación de A. Chandimal Nicholas publicado en mayo de 2020, en Canadá, durante la pandemia de COVID-19 de 2020, el Ministro de Salud firmó la Orden provisional sobre la importación y venta de dispositivos médicos para su uso en relación con el COVID-19. , que permitió un acceso acelerado a los dispositivos médicos COVID-19 para uso de los proveedores de atención médica. Además, según Health Canada, la Orden Provisional ayudó a aprobar rápidamente la importación y venta de dispositivos médicos COVID-19.
Además, durante la pandemia de COVID-19 de 2020, en los Estados Unidos, la Administración de Alimentos y Medicamentos (FDA) emitió Autorizaciones de uso de emergencia (EUA) para dispositivos médicos para diagnosticar COVID-19 y equipos de protección personal necesarios para proteger a los proveedores de atención médica que interactúan con los pacientes.
En Estados Unidos, los dispositivos médicos son gestionados por la Administración de Alimentos y Medicamentos (FDA) para garantizar la seguridad y eficacia de los dispositivos. El Centro de Dispositivos y Salud Radiológica (CDRH) es un segmento de la Administración de Alimentos y Medicamentos (FDA). Los dispositivos de Clase II requieren controles notables para 'etiquetado, orientación, seguimiento, planificación, estándares de desempeño y observación posterior a la comercialización', y la mayoría requiere notificación previa a la comercialización 510(k) para evaluar la equivalencia sustancial con un dispositivo comercializado legalmente.
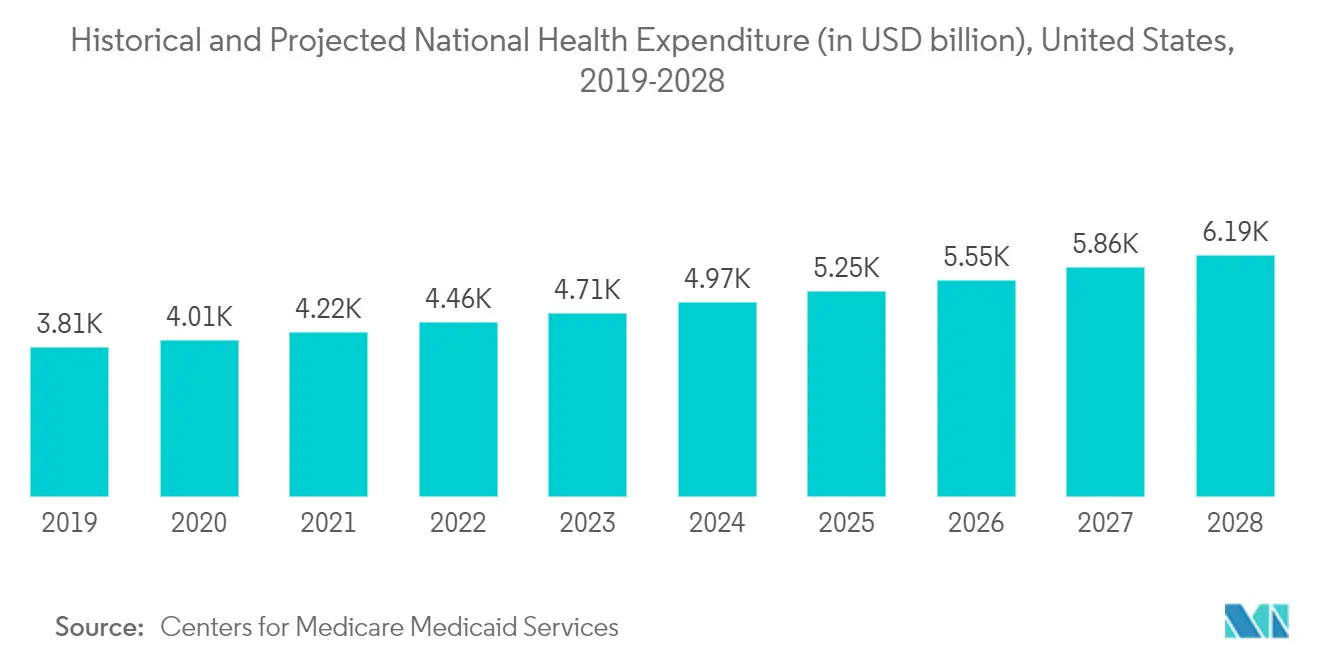
Según el Centro de Servicios de Medicare y Medicaid, el gasto sanitario de Estados Unidos creció un 4,6% en 2018, alcanzando los 3,6 billones de dólares o 11.172 dólares por persona. Como porcentaje del Producto Interno Bruto del país, el gasto en salud representó el 17,7%. Además, con la creciente aprobación de dispositivos médicos en la región, la creciente demanda de servicios de pruebas de dispositivos médicos puede impulsar el crecimiento del mercado. Por lo tanto, teniendo en cuenta los factores mencionados anteriormente, se espera que impulse el crecimiento del mercado en la región de América del Norte durante el período previsto.
Descripción general de la industria de pruebas de dispositivos médicos
El mercado de pruebas y certificación de dispositivos médicos está muy consolidado y pocas empresas brindan servicios de prueba y certificación. Se ha observado que con el creciente mercado de dispositivos médicos, se espera que más empresas ingresen al mercado en el futuro. Las pequeñas y medianas empresas podrían ganar una cuota de mercado sustancial en los próximos años. Algunos actores del mercado incluyen BSI Group, Intertek Group PLC, Institute for Testing and Certification Inc., Eurofins Scientific y SGS SA, entre otros.
Líderes del mercado de pruebas de dispositivos médicos
-
Eurofins Scientific
-
Institute for Testing and Certification Inc.
-
BSI Group
-
SGS SA
-
Intertek Group PLC
- *Nota aclaratoria: los principales jugadores no se ordenaron de un modo en especial
Noticias del mercado de pruebas de dispositivos médicos
- En enero de 2022, TÜV SÜD amplió su laboratorio de pruebas de dispositivos médicos en New Brighton, Minnesota. El laboratorio de última generación proporcionará una amplia gama de pruebas químicas y biológicas de dispositivos médicos que complementan las capacidades actuales de prueba de dispositivos médicos activos de TÜV SÜD.
- En enero de 2022, DNV, un proveedor global de certificación, aseguramiento y gestión de riesgos, adquirió MEDCERT para ampliar su huella de aseguramiento de dispositivos médicos.
Segmentación de la industria de pruebas de dispositivos médicos
Según el alcance del informe, las pruebas, certificación y auditoría de dispositivos médicos son necesarias para garantizar la seguridad de los dispositivos. Estas pruebas y certificación pueden ser proporcionadas por un tercero bajo la organización de auditoría reconocida. El mercado mundial de pruebas y certificación de dispositivos médicos está segmentado por tipo de servicio (servicios de prueba, servicios de inspección, servicios de certificación y otros servicios), tipo de abastecimiento (interno y subcontratado), clase de dispositivo (clase I, clase II y clase III). ), tecnología (dispositivo médico de implante activo, dispositivo médico activo, dispositivo médico no activo, dispositivo médico de diagnóstico in vitro, dispositivo médico oftálmico, dispositivo médico ortopédico y dental, y otras tecnologías) y geografía (América del Norte, Europa, Asia Pacífico , Oriente Medio y África, y América del Sur). El informe ofrece el valor (en millones de dólares) de los segmentos anteriores.
| Por tipo de servicio | Servicios de prueba | ||
| Servicios de inspección | |||
| Servicios de certificación | |||
| Otros servicios | |||
| Por tipo de abastecimiento | Interno | ||
| Subcontratado | |||
| Por clase de dispositivo | Clase I | ||
| Clase II | |||
| Clase III | |||
| Por tecnología | Dispositivo médico de implante activo | ||
| Dispositivo médico activo | |||
| Dispositivo médico no activo | |||
| Dispositivo médico de diagnóstico in vitro | |||
| Dispositivo médico oftálmico | |||
| Dispositivo médico ortopédico y dental | |||
| Otras tecnologías | |||
| Por geografía | América del norte | Estados Unidos | |
| Canada | |||
| México | |||
| Europa | Alemania | ||
| Reino Unido | |||
| Francia | |||
| Italia | |||
| España | |||
| El resto de Europa | |||
| Asia-Pacífico | Porcelana | ||
| Japón | |||
| India | |||
| Australia | |||
| Corea del Sur | |||
| Resto de Asia-Pacífico | |||
| Medio Oriente y África | CCG | ||
| Sudáfrica | |||
| Resto de Medio Oriente y África | |||
| Sudamerica | Brasil | ||
| Argentina | |||
| Resto de Sudamérica | |||
Preguntas frecuentes sobre investigación de mercado de pruebas de dispositivos médicos
¿Qué tamaño tiene el mercado mundial de pruebas y certificación de dispositivos médicos?
Se espera que el tamaño del mercado mundial de pruebas y certificación de dispositivos médicos alcance los 10,57 mil millones de dólares en 2024 y crezca a una tasa compuesta anual del 3,80% hasta alcanzar los 12,73 mil millones de dólares en 2029.
¿Cuál es el tamaño actual del mercado global Pruebas y certificación de dispositivos médicos?
En 2024, se espera que el tamaño del mercado mundial de pruebas y certificación de dispositivos médicos alcance los 10,57 mil millones de dólares.
¿Quiénes son los actores clave en el mercado global de Pruebas y certificación de dispositivos médicos?
Eurofins Scientific, Institute for Testing and Certification Inc., BSI Group, SGS SA, Intertek Group PLC son las principales empresas que operan en el mercado global de certificación y pruebas de dispositivos médicos.
¿Cuál es la región de más rápido crecimiento en el mercado global de Pruebas y certificación de dispositivos médicos?
Se estima que Asia Pacífico crecerá a la CAGR más alta durante el período previsto (2024-2029).
¿Qué región tiene la mayor participación en el mercado global de pruebas y certificación de dispositivos médicos?
En 2024, América del Norte representa la mayor cuota de mercado en el mercado mundial de pruebas y certificación de dispositivos médicos.
¿Qué años cubre este mercado global de pruebas y certificación de dispositivos médicos y cuál fue el tamaño del mercado en 2023?
En 2023, el tamaño del mercado mundial de pruebas y certificación de dispositivos médicos se estimó en 10,18 mil millones de dólares. El informe cubre el tamaño histórico del mercado global de Pruebas y certificación de dispositivos médicos durante los años 2019, 2020, 2021, 2022 y 2023. El informe también pronostica el tamaño del mercado global de Pruebas y certificación de dispositivos médicos para los años 2024, 2025, 2026, 2027 , 2028 y 2029.
Nuestros informes más vendidos
Popular Health Services Reports
Popular Healthcare Reports
Other Popular Industry Reports
Informe de la industria de pruebas de dispositivos médicos
Estadísticas para la participación de mercado, el tamaño y la tasa de crecimiento de ingresos de Pruebas de dispositivos médicos en 2024, creadas por Mordor Intelligence™ Industry Reports. El análisis de Pruebas de dispositivos médicos incluye una perspectiva de previsión del mercado hasta 2029 y una descripción histórica. Obtenga una muestra de este análisis de la industria como descarga gratuita del informe en PDF.