Markt-Trends von Globale Prüfung und Zertifizierung von Medizinprodukten Industrie
Für das Testdienstleistungssegment wird im Prognosezeitraum ein schnelles Wachstum erwartet
Weltweit werden Medizinprodukte durch verschiedene Regulierungsbehörden und Compliance-Behörden reguliert. Dies liegt vor allem daran, dass die Endnutzer dieser Geräte von diesen Medizinprodukten herausragende Leistung, Wirksamkeit und Sicherheit erwarten. Daher ist es für die Hersteller zwingend erforderlich, eine Teststrategie für Medizinprodukte richtig zu definieren und umzusetzen, die das Gerät effektiver macht und die Produktion durch die Qualitätsbestätigung erleichtert
Aufgrund der COVID-19-Pandemie hat die Europäische Kommission (EK) im April 2020 einen Vorschlag zur Verschiebung des Geltungstermins der Medizinprodukteverordnung (MDR) um ein Jahr angenommen, da die COVID-19-Pandemie die Nachfrage nach bestimmten Medizinprodukten erhöht hat. Dies war von entscheidender Bedeutung, um Risiken oder Schwierigkeiten möglicher Engpässe bei solchen Geräten zu vermeiden. Darüber hinaus hat die COVID-19-Pandemie klinische Studien verzögert und Prozesse für Medizinprodukte gestört
Einige der medizinischen Geräte erlebten während der COVID-19-Pandemie 2020 einen plötzlichen Nachfrageschub. Beispielsweise waren Beatmungsgeräte für COVID-19-Patienten sehr gefragt, da sie in Krankenhäusern ein wichtiges Hilfsmittel sind, um Patienten in kritischen Zuständen am Leben zu halten. Beispielsweise gab Medtronic PLC im März 2020 bekannt, dass es die Produktion bisher um mehr als 40 % gesteigert hat und auf dem besten Weg ist, seine Kapazität zur Herstellung und Lieferung von Beatmungsgeräten als Reaktion auf den dringenden Bedarf von Patienten und Gesundheitssystemen auf der ganzen Welt mehr als zu verdoppeln Welt, die mit COVID-19 konfrontiert ist
Im Juni 2020 kündigte die Intertek Group PLC die Ausweitung der Dienstleistungen für persönliche Schutzausrüstung an, um die Prüfung von N95-Atemschutzmasken gemäß den Anforderungen des National Institute for Occupational Safety and Health (NIOSH) einzuschließen. Mit dieser Erweiterung erweiterte das Unternehmen auch seine Lösungen und Ressourcen, um Kunden und die globale Gemeinschaft während der COVID-19-Pandemie zu unterstützen
Eine effektive Teststrategie für Medizinprodukte erfordert mehrere Testanforderungen. Die Anforderungssätze sind erforderlich, um die Testdurchführung zu vereinfachen, da Tests kontinuierlich in verschiedenen Phasen des gesamten Herstellungsprozesses durchgeführt werden, von der Komponentenauswahl bis zur Endmontage eines medizinischen Geräts. Jede Stufe hat unterschiedliche Anforderungen und unterschiedliche Parameter, die erfüllt werden müssen. Mit der zunehmenden Zahl medizinischer Geräte könnten daher auch diese Testdienstleistungen zunehmen, was voraussichtlich das Gesamtwachstum des Marktes steigern wird
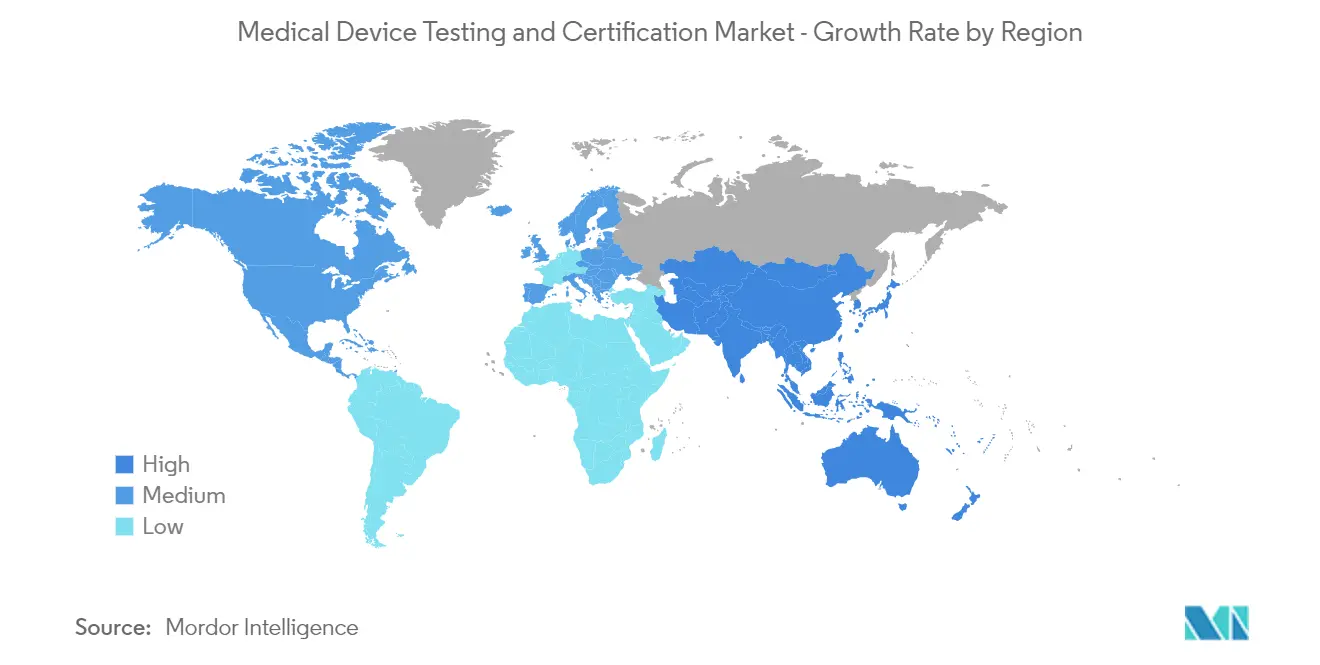
Nordamerika dominiert den Markt und es wird erwartet, dass dies auch im Prognosezeitraum der Fall sein wird
Zu den Faktoren, die das Marktwachstum in der nordamerikanischen Region vorantreiben, gehören die verstärkte Fokussierung auf die Qualität der Medizingeräte und die Präsenz einer großen Anzahl von Unternehmen, die die Medizingerätebranche bedienen, sowie die Präsenz eines gut entwickelten Gesundheitswesens Präsenz führender multinationaler Medizintechnikunternehmen
Laut einem im Mai 2020 veröffentlichten Forschungsartikel von A. Chandimal Nicholas unterzeichnete der Gesundheitsminister in Kanada während der COVID-19-Pandemie 2020 die vorläufige Verordnung über die Einfuhr und den Verkauf von Medizinprodukten zur Verwendung im Zusammenhang mit COVID-19 , die einen beschleunigten Zugang zu medizinischen COVID-19-Geräten zur Verwendung durch Gesundheitsdienstleister ermöglichte. Darüber hinaus hat die einstweilige Anordnung laut Health Canada dazu beigetragen, die Einfuhr und den Verkauf von COVID-19-Medizinprodukten schnell zu genehmigen
Darüber hinaus erteilte die Food and Drug Administration (FDA) während der COVID-19-Pandemie 2020 in den Vereinigten Staaten Notfallgenehmigungen (Emergency Use Authorizations, EUA) für medizinische Geräte zur Diagnose von COVID-19 und persönliche Schutzausrüstung, die zum Schutz von Gesundheitsdienstleistern bei der Interaktion mit Patienten erforderlich ist
In den Vereinigten Staaten werden Medizinprodukte von der Food and Drug Administration (FDA) verwaltet, um die Sicherheit und Wirksamkeit der Geräte zu gewährleisten. Das Center for Devices and Radiological Health (CDRH) ist ein Segment der Food and Drug Administration (FDA). Geräte der Klasse II erfordern umfangreiche Kontrollen für Kennzeichnung, Anleitung, Nachverfolgung, Planung, Leistungsstandards und Beobachtung nach dem Inverkehrbringen, und die meisten erfordern eine Vorabmeldung 510(k), um die wesentliche Gleichwertigkeit mit einem rechtmäßig vermarkteten Gerät zu beurteilen
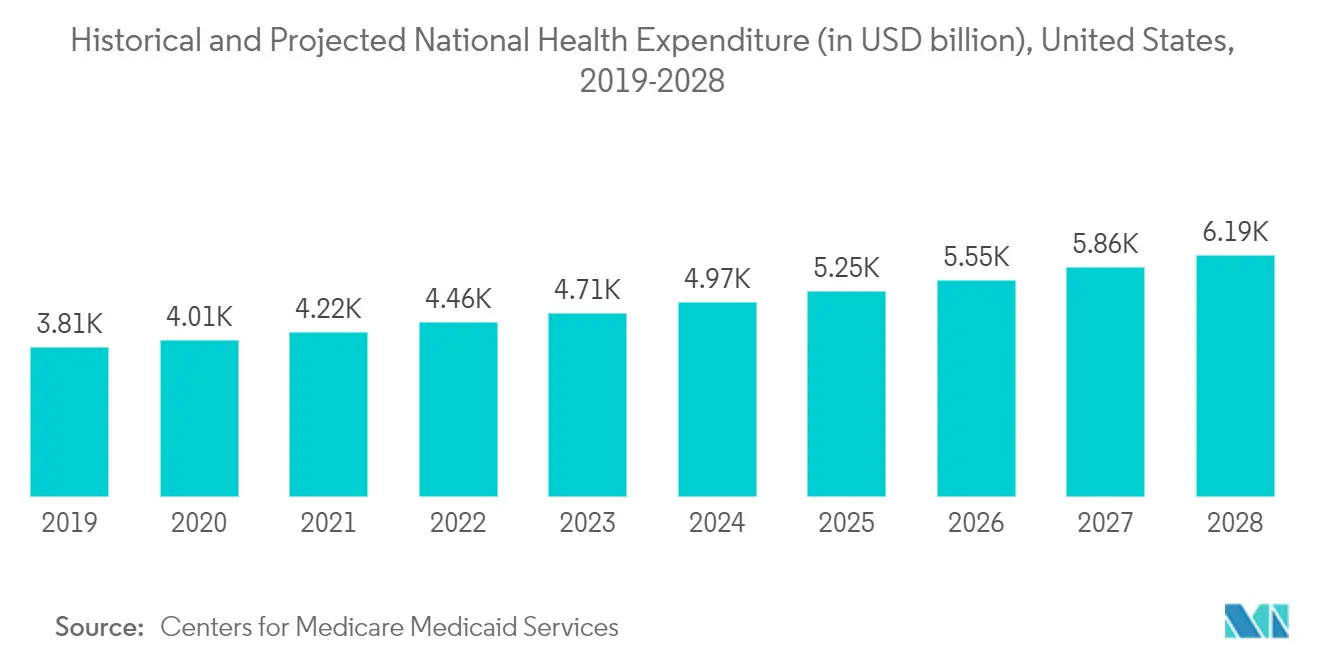
Nach Angaben des Center for Medicare Medicaid Services stiegen die Gesundheitsausgaben der Vereinigten Staaten im Jahr 2018 um 4,6 % und erreichten 3,6 Billionen US-Dollar oder 11.172 US-Dollar pro Person. Im Verhältnis zum Bruttoinlandsprodukt des Landes machten die Gesundheitsausgaben 17,7 % aus. Darüber hinaus könnte mit der zunehmenden Zulassung medizinischer Geräte in der Region eine steigende Nachfrage nach Testdienstleistungen für medizinische Geräte das Marktwachstum ankurbeln. Unter Berücksichtigung der oben genannten Faktoren wird daher erwartet, dass es das Marktwachstum in der nordamerikanischen Region im Prognosezeitraum ankurbeln wird