Marktgröße von Globale Prüfung und Zertifizierung von Medizinprodukten Industrie
| Studienzeitraum | 2019 - 2029 |
| Marktgröße (2024) | USD 10.55 Billion |
| Marktgröße (2029) | USD 12.71 Billion |
| CAGR (2024 - 2029) | 3.80 % |
| Schnellstwachsender Markt | Asien-Pazifik |
| Größter Markt | Nordamerika |
| Marktkonzentration | Niedrig |
Hauptakteure
*Haftungsausschluss: Hauptakteure in keiner bestimmten Reihenfolge sortiert |
Benötigen Sie einen Bericht, der die Auswirkungen von COVID-19 auf diesen Markt und sein Wachstum widerspiegelt?
Marktanalyse für medizinische Gerätetests
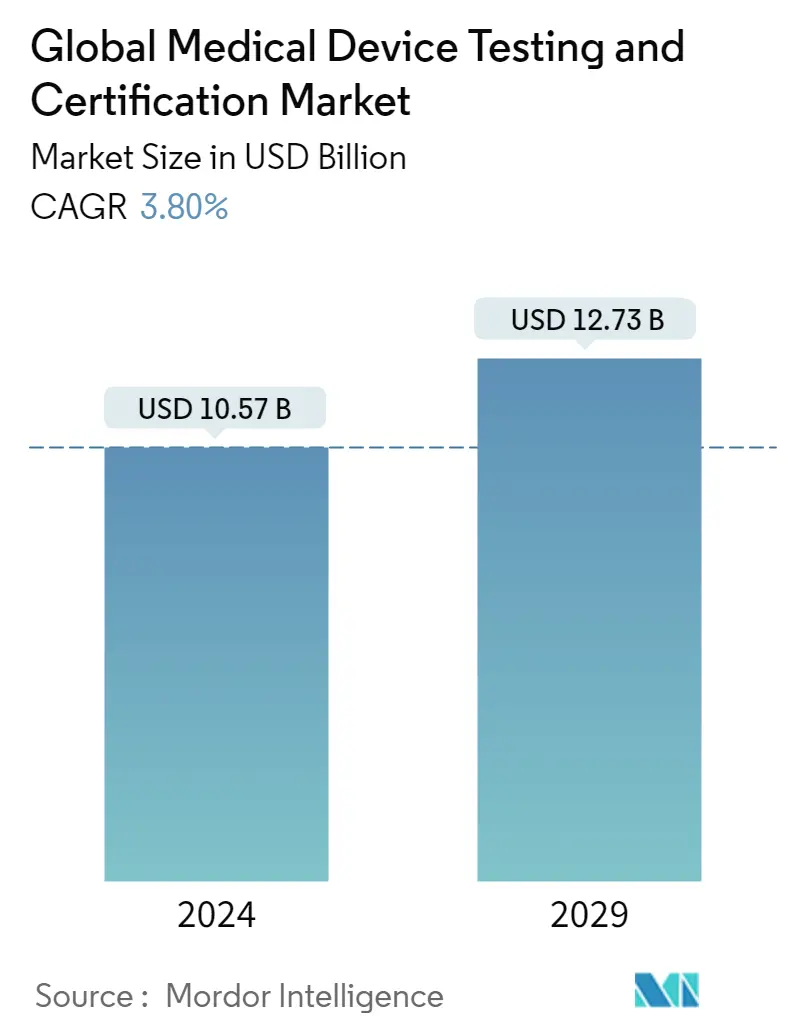
Die globale Marktgröße für die Prüfung und Zertifizierung medizinischer Geräte wird im Jahr 2024 auf 10,57 Milliarden US-Dollar geschätzt und soll bis 2029 12,73 Milliarden US-Dollar erreichen, was einem durchschnittlichen jährlichen Wachstum von 3,80 % im Prognosezeitraum (2024–2029) entspricht
Während des COVID-19-Ausbruchs im Jahr 2020 wurden mehrere Maßnahmen ergriffen, um die Übertragung von Krankheiten zu verhindern, wie z. B. Lockdown-Maßnahmen und die Einschränkung von Import-Export-Aktivitäten zwischen den Ländern, was die Lieferkette störte und sich somit negativ auf den untersuchten Gesamtmarkt auswirkte
Darüber hinaus haben die durch COVID-19 verursachten Störungen in den internationalen Lieferketten weltweit zu Engpässen bei wichtigen medizinischen Geräten geführt. Daher haben viele Länder konkrete Maßnahmen ergriffen, um die Engpässe durch den Import von Ausrüstung zu lindern, beispielsweise durch die inländische Herstellung medizinischer Geräte. Darüber hinaus wird erwartet, dass die inländische Herstellung wesentlicher medizinischer Geräte Handelshemmnisse überwindet und gleichzeitig Produktqualität und Marktstabilität gewährleistet
Nach Angaben der British Standards Institution (BSI) überprüfte das Unternehmen im Februar 2020 unter Berücksichtigung der Auswirkungen der COVID-19-Pandemie Prozesse und plante ein Programm, um das Risiko für Kunden und Kollegen der British Standards Institution (BSI) bei gleichzeitiger Aufrechterhaltung zu minimieren Akkreditierungsanforderungen und die Minderung potenzieller globaler Handelsrisiken
Die Medizinprodukte unterliegen der Einhaltung strenger Regulierungsprotokolle, da die Gewährleistung der Wirksamkeit und Sicherheit von Medizinprodukten von entscheidender Bedeutung ist. Daher ist es für jedes Gerät zwingend erforderlich, vor dem Markteintritt nationale und internationale Standards einzuhalten. Die Standardrichtlinien für Medizinprodukte variieren von Land zu Land und jeder Hersteller ist verpflichtet, diese Richtlinien für die Vermarktung oder den Verkauf seiner Produkte in einem Land zu befolgen. Beispielsweise folgen die Vereinigten Staaten den Richtlinien der Food and Drug Administration (FDA), Europa erwägt die CE-Zulassung (Conformitè Europëenne), Kanada benötigt eine Health Canada-Registrierung und Indien benötigt eine Genehmigung der Central Drugs Standard Control Organization (CDSCO). Diese vielfältigen Regulierungslandschaften bestimmen den Test- und Zertifizierungsmarkt
Da die Vorschriften in jedem Land unterschiedlich sind, ist es für jeden Hersteller medizinischer Geräte von entscheidender Bedeutung, sich zu registrieren oder die Richtlinien des jeweiligen Landes zu erhalten, was wiederum darauf hinweist, dass autorisierte Dritte ihre Geräte registrieren müssen. Die nationalen Regulierungsbehörden jedes Landes bevorzugen, dass die Hersteller, die ihre Produkte in dem jeweiligen Land verkaufen, die Standardrichtlinien einhalten und diese von einem externen Zertifizierungssystem überprüfen lassen
Dies kann dazu führen, dass der Test- und Zertifizierungsmarkt vorangetrieben wird und der einfache Marktzugang verbessert wird. Die anderen Faktoren, wie der zunehmende Bedarf an Validierung und Verifizierung (VV) für medizinische Geräte, treiben den Markt für die Prüfung und Zertifizierung medizinischer Geräte an. Es wird jedoch erwartet, dass ein Faktor wie die Vielfalt der Regulierung das Marktwachstum im Prognosezeitraum behindern wird